Perkembangan Teori (Model) Atom Dalton, Thompson, Rutherford, dan Bohr – Setiap benda yang kita lihat tersusun dari partikel- partikel yang sangat kecil, partikel-partikel tersebut adalah atom. Atom dipercaya sebagai penyusun setiap materi namun sampai saat ini bentuk atom masih belum diketahui, para ahli hanya mereka-reka dan memprediksi dari bentuk atom itu sendiri atau sering disebut model atom. Atom diperkirakan memiliki jari-jari 3 – 5 nm. Seiring berkembangnya teori atom melalui kecanggihan alat-alat laboratorium maka model atom pun berulangkali mengalami perubahan.
Teori Atom Dalton

Pencetus teori atom modern pertama adalah John Dalton seorang guru dan ahli kimia yang berasal dari Inggris.Berdasarkan pemikiran konsep atom Democritus sesuai dengan Hukum Kekekalan Massa (Massa zat sebelum dan sesudah reaksi sama) dan Hukum Perbandingan Tetap (perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap dan tertentu) dan didasarkan atas tiga asumsi pokok yaitu:
- Setiap unsur kimia tersusun atas partikel-partikel kecil yang tidak dapat dihancurkan dan dipisahkan yang disebut atom. Selama mengalami perubahan kimia, atom tidak bisa diciptakan maupun dimusnahkan.
- Semua atom dari semua unsur mempunyai massa dan sifat yang sama, tetapi atom-atom dari suatu unsur berbeda dengan atom – atom dari unsur yang lain, baik massa maupun sifat – sifatnya yang berlainan.
- Dalam senyawa kimiawi, atom – atom dari unsur yang berlainan melakukan ikatan dengan perbandingan angka sederhana.
Maka pada tahun 1803 Dalton merumuskan teorinya:
- Materi tersusun atas partikel-partikel terkecil yang disebut atom
- Atom – atom penyusun unsur bersifat identik
- Atom suatu unsur tidak dapat diubah menjadi atom unsur lain
- Senyawa tersusun atas dua jenis atom atau lebih dengan perbandingan tetap dan tertentu
- Pada reaksi kimia terjadi penataulangan atom – atom yang bereaksi. Reaksi kimia terjadi karena pemisahan atom-atom dalam senyawa untuk kemudian bergabung kembali membentuk senyawa baru
Kesimpulan dari teori atom oleh John Dalton adalah atom merupakan partikel terkecil yang tidak bisa dibagi – bagi lagi.
Teori Atom Thompson

Pada tahun 1897 J. J. Thompson menemukan elektron melalui percobannya menggunakan tabung sinar katoda bahwa sinar katoda adalah partikel bermuatan negatif yang ada pada setiap materi. Menurut Thompson, atom berbentuk bulat dimana muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh elektron-elektron yang berada di antara muatan positif. Model atom Thompson dianalogikan seperti roti kismis , dimana atom atom terdiri dari muatan bermuatan positif dan didalamnya tersebar elektron bagaikan kismis pada roti kismis sehingga teori atom Thompson sering disebut teori roti kismis.
Teori Atom Rutherford

Pada tahun 1911 Hans Geiger dan Ernest Marsden membantu Rutherford melakukan percobaan dengan hamburan sinar alpha yang bermuatan positif pada plat emas yang sangat tipis. Berdasarkan hasil percobaan tersebut disimpulkan bahwa :
- Sebagian ruang dalam atom adalah ruang hampa, partikel sinar alpha diteruskan
- Di dalam atom terdapat bagian yang sangat kecil dan padat disebut inti atom, partikel sinar alpha dipantulkan kembali
- Muatan inti atom dan partikel sinar alpha sejenis, sebagian partikel sinar alpha dibelokkan
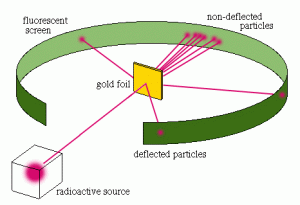
Hasil Percobaan tersebut membuat Rutherford mengemukakan teori atomnya yaitu:
- Atom tersusun dari :
- Inti atom yang bermuatan positif
- Elektron-elektron bermuatan negatif dan mengelilingi inti
- Semua proton berada di inti atom sehingga membuat inti atom bermuatan positif
- Sebagian besar volume atom adalah ruang kosong. Hampir semua massa atom terpusat di inti atom
- Jumlah proton pada inti berjumlah sama dengan jumlah elektron yang mengelilingi inti, sehingga atom bermuatan netral.
Namun teori yang dikemukakan Rutherford ini memeliki beberapa kelemahan antara lain:
- Teori atom Rutherford tidak mampu menjelaskan letak elektron dan distribusinya terhadap inti atom
- Tidak dapat menjelaskan mengapa elektron tidak jatuh ke inti atom, karena sesuai dengan hukum fisika Maxwell, Jika partikel bermuatan neegatif bergerak mengelilingi partikel bermuatan berlawanan maka akan mengalami percepatan dan memancarkan energi berupa gelombang elektromagnetik, sehingga energi elektron akan semakin berkurang yang akhirnya jatuh ke inti
- Tidak dapat menjelaskan spektrum garis pada atom hidrogen
Teori Atom Niels Bohr

Kelemahan pada teori mampu dijawab oleh Niels Bohr pada tahun 1913. Melalui pengamatan pada spektrum atom , spektrum garis menunjukkan bahwa elektron beredar pada lintasan – lintasa energi tertentu. Dalton mengemukakan dua postulat sebagai berikut:
- Elektron mengelilingi inti atom pada lintasan tertentu yang stasioner disebut orbit/kulit. Walaupun elektron bergerak cepat tetapi elektron tidak memancarkan atau menyerap energi sehingga energi elektron tidak mengalami percepatan. Hal ini berarti elektron yang berputar mengelilingi inti atom mempunyai lintasan tetap sehingga elektron tidak jatuh ke inti.
- Elektron dapat berpindah dari kulit yang satu ke kulit yang lain dengan memancarkan atau menyerap energi. Energi yang dipancarkan atau diserap ketika elektron berpindah-pindah kulit disebut foton.
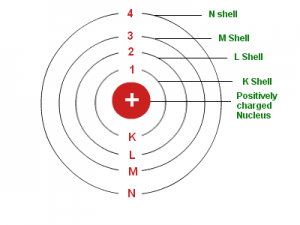
Model atom Bohr bisa dianalogikan berbentuk seperti tata surya dimana elektron mengelilingi inti atom sesuai orbitnya namun jika pada sistem tata surya satu orbit hanya ditempati satu planet maka pada model atom Bohr untuk satu orbit bisa ditempati lebih dari satu elektron. Pada model atom Bohr ini menjelasakan mengenai susunan elektron pada masing – masing kulit/orbit atom atau lebih dikenal mengenai konfigurasi elektron.
Sama seperti Teori Atom Rutherford, Teori atom Bohr ternyata juga memiliki kelemahan, antara lain:
- Hanya mampu menjelaskan spektrum atom hidrogen, belum menjelaskan mengenai spektrum atom yang lebih kompleks
- Orbit elektron berbentuk elips bukan lingkaran
- Bohr menganggap elektron hanya sebagai partikel, tidak sebagai partikel dan gelombang, sehingga kedudukan elektron dalam atom hanya sebuah kebolehjadian.
Referensi
- BSE KIMIA untuk SMA/MA karangan Budi Utami, Agung Nugroho CS, Lina Mahardiani, Sri Yamtinah, Bakti Mulyani
- BSE KIMIA karangan Ari Hernanto, Ruminten
- BSE Memahami Kimia karangan Irvan Permana






