Struktur Atom : Proton, Neutron, dan Elektron – Seperti artikel yang telah saya buat sebelumnya mengenai teori atom, khususnya teori atom Dalton dijelaskan bahwa atom merupakan penyusun materi terkecil yang tidak dapat dibagi – bagi lagi namun atom juga masih memiliki sub partikel yaitu proton, elektron, dan neutron yang mana masing – masing bermuatan positif, negatif, dan netral. Gambaran secara umum mengenai struktur atom adalah inti atom terdiri dari proton dan neutron, sedangkan elektron mengorbit inti atom sesuai dengan kulit atomnya (orbitalnya).
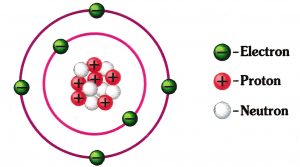
Struktur Atom
Elektron
Diawali dengan temuan metode elektrolisis, yaitu cara menguraikan suatu senyawa menjadi unsur – unsurnya dengan bantuan arus listrik oleh Sir Humphry Davy dan muridnya Michael Faraday diketahuilah bahwa atom mengandung muatan negatif. Pada abad ke-19, Julius Plucker melakukan eksperimen dengan menaruh dua plat logam yang ditempatkan pada tabung lampu gas secara terpisah dan diisi gas pada tekanan rendah, masing – masing plat logam membawa muatan positif (anoda) dan muatan negatif (katoda). Ketika muatan listrik bertegangan tinggi dialirkan maka munculah nyala sinar dari katoda menuju anoda yang disebut sinar katoda. Sayangnya pada eksperimen ini Plucker mengira sinar tersebut sinar biasa akibat listrik bertegangan tinggi, kemudian William Crookes mengulangi eksperiman Plucker tersebut dan mengemukakan bahwa sinar katoda adalah partikel – partikel yang belum dikenal sebelumnya.
Hasil dari eksperimen yang dilakukan oleh William Crookes adalah sebagai berikut :
- Partikel sinar katoda memiliki muatan negatif
- Partikel sinar katoda memiliki massa karena mampu memutar baling – baling yang diletakkan di antara katoda dan anoda
- Partikel sinar katoda dimiliki semua materi
Pada tahun 1891, partikel sinar katoda tersebut diberi nama elektron oleh George Johnstone Stoney, sayangnya pada saat itu para ilmuwan masih bingung mengenai elektron tersebut karena mereka meyakini atom adalah penyusun materi terkecil sesuai dengan teori atom yang dikemukakan Dalton. Pada tahun 1897 J.J. Thompson berhasil membuktikan bahwa elektron adalah partikel penyusun atom, dan J.J. Thompson mampu menghitung perbandingan muatan terhadap massa elektron
e/m = 1,76 x 108 C/g
maka massa 1 elektron = ![]()
= 1,602 x 10-19 / 1,76 x 108
= 9,11 x 10-28 gram
Setelah ditemukannya elektron ini, J.J. Thompson mengemukakan teori atomnya yang dikenal dengan teori roti kismis sekaligus membuat model atom Dalton tidak bisa diterima lagi.
Inti Atom
Proton
Penemuan elektron menmbuat paara ilmuwan yakin bahwa di dalam atom terdapat partikel – partikel lain yang lebih kecil karena apabila atom hanya berisi elektron yang bermassa sangat kecil, itu tidak sesuai dengan massa atom sesungguhnya. Pada 1886, Eugen Goldstein melakukan eksperimen dengan memodifikasi eksperimen Plucker dengan cara melubangi lempeng katodanya sehingga gas yang berada di belakang lempeng katoda berpijar akibat radiasi dari anoda yang menerobos lubang pada lempeng katoda. Sinar ini disebut sinar anoda dan bermuatan positif, yang meiliki sifat antara lain :
- Berupa radiasi partikel sehingga dapat memutar baling – baling di antara katoda dan anoda
- Bermuatan positif karena dalam medan listrik/magnet akan dibelokkan ke kutub negatif
- Bergantung pada jenis gas dalam tabung
Partikel terkecil di dapat dari gas hidrogen yang kemudian disebut Proton.
Massa 1 proton = 1 sma = 1,66 x 10-24 gram
Muatan 1 proton = +1 = 1,6 x 10-19 C
Selanjutnya Ernest Rutherford melakukan percobaan untuk mengetahui kedudukan partikel – pertikel dalam atom dengan menembakkan sinar alpha pada lempengan emas yang tipis. Dari percobaan tersebut sebagian besar sinar alpha yang ditembakkan pada lempeng emas tersebut diteruskan dan sebagian kecil dibelokkan atau dipantulkan sehingga diketahui bahwa atom tersebut bukan sebuah bola pejal sesuai teori atom Thompson. Partikel yang dipantulkan tersebut diperkirakan akibat menabrak sesuatu yang padat di dalam atom.
Hasil dari percobaan Rutherford adalah sebagai berikut :
- Atom bukan berupa bola pejal, karena sebagian besar sinar alpha diteruskan yang membuktikan sebagian besar volume atom kosong
- Partikel yang dibelokkan atau dipantulkan adalah yang menambrak inti atom, karena keduanya bermuatan positif
Dari percobaan tersebut, Rutherford mengusulkan model atomnya dengan inti atom diisi oleh proton dan dikelilingi elektron dimana jumlah elektron dan proton sama sehingga atom bermuatan positif, selain itu Rutherford juga menduga ada partikel lain di inti atom yang membuat partikel – partikel bermuatan positif tidak saling menolak. Rutherfod juga memperkirakan jari – jari atom sekitar 10-8cm dan jari – jari inti atom sekitar 1013cm.
Neutron
Penemuan neutron diawali dari percobaan W. Bothe dan H. Becker menembaki lempeng berilium dengan partikel sinar alpha yang diperoleh dari sampel polonium yang menghasilkan pancaran radiasi yang memiliki daya tembus yang besar. Pada awalnya radiasi ini dianggap sebagai radiasi sinar gamma nemun terdapat perbedaan daya tembus antara sinar ini dan sinar gamma. Pada tahun 1932, James Chadwick mengusulkan hipotesis tentang struktur inti atom dari percobaan W. Bothe dan H. Becker. Menurut Chadwick pancaran radiasi tersebut tidak bermuatan (netral) sehingga dinamakan neutron. Hasil percobaan tersebut menunjukkan bahwa neutron bukanlah partikel yang stabil jike berada di luar inti atom. Massa 1 neutron sebesar 1,0086654 sma atau 1,6748 x 10-27 kg, hampir sama dengan proton atau bisa disamakan.
|
Partikel |
Lambang | Penemu | Massa (sma) | Massa (gram) | Muatan (Coulomb) |
Muatan relatif |
| Elektron | e | J.J. Thompson | 0,00055 | 9,11 x 10-28 | -1,6 x 10-19 | -1 |
| Proton | P | Goldstein | 1,00728 | 1,6726 x 10-24 | +1,6 x 10-19 | +1 |
| Neutron | n | Chadwick | 1,00866 | 1,6748 x 10-24 | 0 | 0 |






